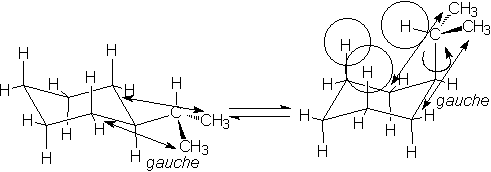
En realidad tenemos una situación parecida a la explicada para el etilciclohexano. El enlace del carbono 1 del anillo con el carbono central del grupo isopropilo (indicado con una flecha curva en la conformación axial) puede girar, de manera que los dos grupos metilo estarán hacia afuera preferentemente. Así, las interacciones de los hidrógenos axiales de las posiciones 3 y 5 con el hidrógeno del isopropilo (indicadas con círculos) son semejantes a las que existen en el metil- y etilciclohexano. ¿Por qué entonces el isopropilo tiene una energía conformacional mayor?. Recordemos que la energía conformacional de un grupo es el cambio de energía libre del equilibrio entre las dos formas silla. La energía libre tiene un término entálpico y otro entrópico. El término entálpico es igual en los tres compuestos, metil-, etil e isopropilciclohexano, porque las interacciones son las mismas, como se ha demostrado gráficamente. El término entrópico depende del orden/desorden o, dicho de otra forma, de los grados de libertad de las conformaciones. En esto el isopropilciclohexano no es igual. En el caso del etilciclohexano la rotación en torno al enlace entre el carbono 1 del anillo y el resto etano (flecha curva) permitía que el grupo metilo se dispusiera hacia afuera del anillo. Pero existen dos posibilidades equivalentes de que esto ocurra (en el esquema sólo se ha dibujado una; en la otra el metilo estaría hacia adentro). Sin embargo es fácil ver que en el isopropilo sólo hay una posibilidad de que los dos metilos estén hacia afuera. Esto resta grados de libertad al isopropilciclohexano frente al etilciclohexano y se refleja en un valor mayor de la energía conformacional del grupo isopropilo.