
La presencia del grupo metilo en orto o meta prácticamente no cambia la basicidad. En posición para sin embargo sí produce un ligero aumento. ¿Cómo podemos explicarlo?
El dato experimental sugiere que el grupo metilo aumenta ligeramente la densidad electrónica del grupo NH2, haciendo que la para-metilanilina sea 0.5 unidades de pKb más básica.
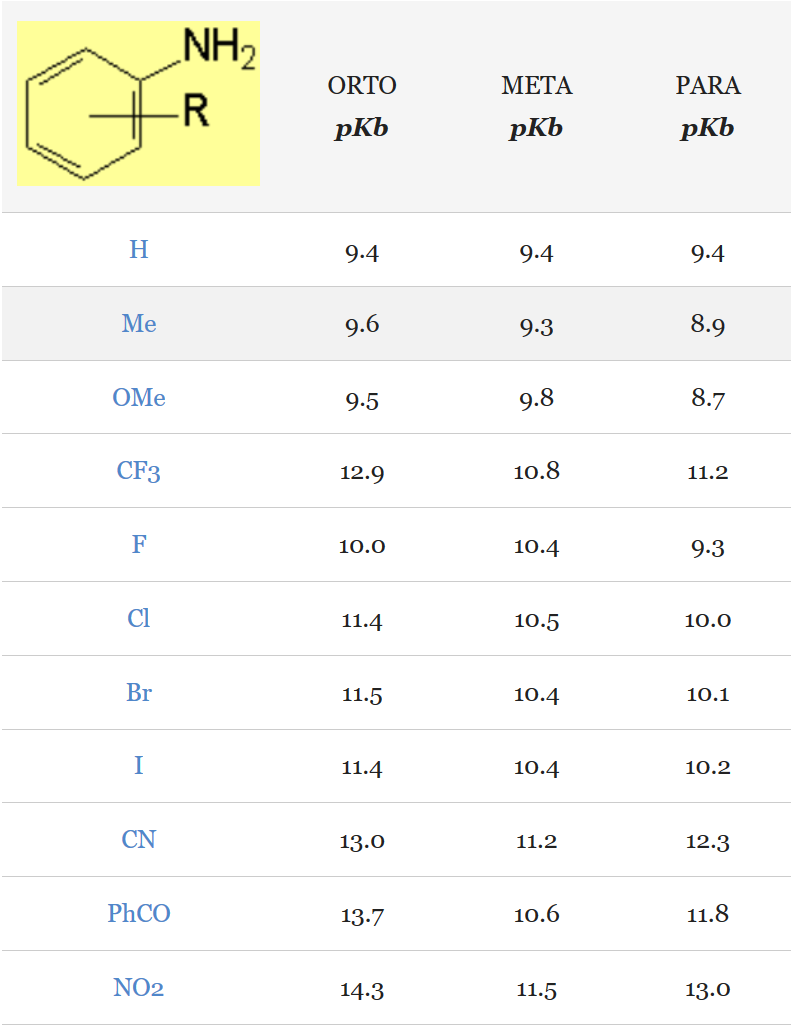
Para explicar cómo un grupo metilo puede producir ese efecto en una posición tan remota al grupo NH2 debemos considerar lo que se denomina formas resonantes hiperconjugativas:
Los carbonos no tienen todos la misma electronegatividad. Hay pequeñas diferencias dependiendo de su hibridación. A mayor carácter "s" los electrones del enlace están más cerca del núcleo y son atraídos con más fuerza. Por tanto, los carbonos del anillo con hibridación sp2 (1/3 de carácter "s") son ligeramente más electronegativos que el carbono del grupo metilo, con hibridación sp3 (1/4 de carácter "s").
Las formas resonantes hiperconjugativas expresan que los enlaces C-H del grupo metilo están más desprovistos de densidad electrónica de lo normal al estar unido al anillo aromático. La pequeña densidad electrónica así creada se deslocaliza por el anillo e inhibe o limita la posible deslocalización del par de electrones no compartido del nitrógeno, explicando así su ligeramente mayor basicidad en la para-metilanilina.
Este efecto no puede expresarse en posición meta.
Sin embargo, sí se podría expresar en la posición orto. Pero la basicidad experimental no se altera prácticamente. Podemos pensar en un efecto de compensación. La mayor densidad electrónica creada por el grupo Me en orto y la hipotética mayor basicidad que ocasiona, está compensada por el efecto estérico que el grupo Me produce al estar tan próximo al grupo NH2.
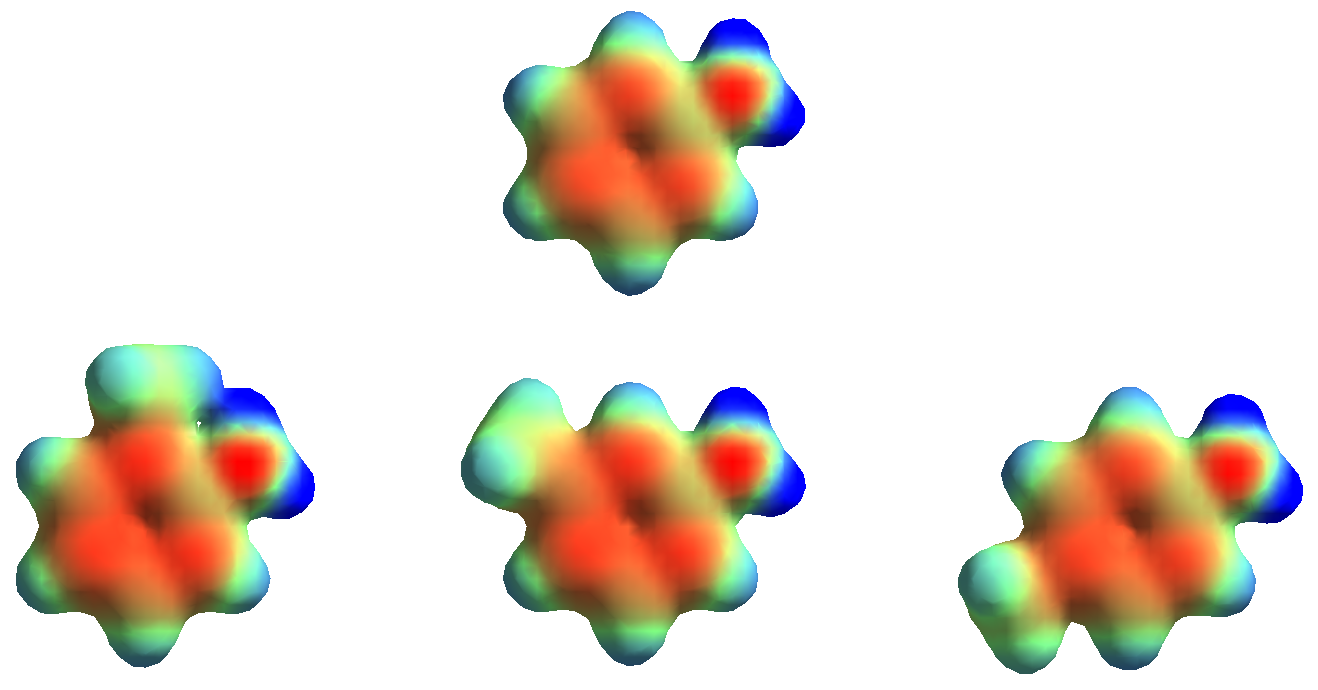
El cálculo de la densidad electrónica no permite apreciar diferencias entre la anilina (arriba) y las tres metilaninilas posibles, lo que está de acuerdo con las pequeñas o nulas variaciones en los valores de pKb experimentales.